新規TLR3アジュバントARNAXによる抗がん免疫療法の開発
1. はじめに
がん治療において、免疫療法は手術、抗がん剤、放射線療法に続く第4の治療法として近年注目されています。免疫は、異物を認識し排除する機構であるとともに、過剰な免疫反応を制御し自己を防御する仕組みを内包しています。PD-1抗体などの免疫チェックポイント阻害剤は、免疫の負の制御機構を解除することで免疫系を活性化させ、がん退縮を導きます。しかし、免疫チェックポイント阻害剤が効果を発揮するのは固形がんで20˜30%であり一部のがん患者に限られます。PD-1抗体の奏功例では腫瘍反応性細胞障害性T細胞(CTL)が存在し腫瘍内に浸潤していることから、抑制解除で再活性化されたCTLによるがん攻撃がおきたと考えられ、がん退縮におけるCTL誘導の重要性が再認識されました。
一方、免疫抑制機構の解除とは別に、腫瘍特異抗原を同定し抗原ペプチドとアジュバントで抗原特異的CTLを増強するペプチドワクチン療法が試みられていますが、成果は得られていません。腫瘍特異的CTLの誘導には、がん抗原とともに抗原提示樹状細胞を活性化するアジュバント(プライミングアジュバント)が必要です。ペプチドワクチン療法では、水酸化アルミニウムゲル(Alum)やMontanideなどのoilが用いられていますが、これらのアジュバントは樹状細胞の活性化ではなく炎症を誘起する事で免疫系を活性化するためCTL誘導は不充分です。樹状細胞を活性化しがん抗原特異的CTLを誘導できるプライミングアジュバントの開発が必要です。
2. ARNAXの開発
樹状細胞サブセットの中で、プロフェッショナル抗原提示樹状細胞(マウスではCD8α+ DC, CD103+ DC, ヒトではCD141+ DC)は、細胞外から取り込んだ抗原を8˜9 merのペプチドとしてMHC クラスI分子にのせCD8+ T 細胞に提示する(クロスプレゼンテーション)能力を有しています。腫瘍特異的CTLの活性化は、プロフェッショナル抗原提示樹状細胞によるがん抗原の提示とともに樹状細胞上の副刺激分子(CD80, CD86)の発現上昇、type I IFN, IL-12などのサイトカインが必要であり、これらは樹状細胞に発現する自然免疫パターン認識レセプター、特にToll-like receptor 3 (TLR3)からのシグナルで誘導されます。TLR3は抗原提示樹状細胞のエンドソームに高発現しており、ウイルス特有の構造である二本鎖RNA(dsRNA)を認識し、TICAM-1(別名TRIF)を介してシグナルを伝達します。TICAM-1シグナルは、IRF-3,NF-κB, AP-1の転写因子を活性化し、IFN-β, IL-12などのサイトカイン産生、副刺激分子の発現上昇、抗原のクロスプレゼンテーションを誘導します。
現在、TLR3リガンドとして用いられている合成dsRNAのpoly(I:C)は強力なアジュバント活性、抗がん活性を有しますが、広範囲の細胞に発現するMDA5を介した全身性のIFN-α/β, 炎症性サイトカイン産生が副作用の原因として問題になっています。従って、MDA5など細胞内RIG-I-like receptorを活性化せずTLR3のみを活性化するアジュバントを開発すれば、抗がん活性を保ちながら過剰な炎症応答を誘起せず、副作用を軽減することができます。我々は、麻疹ウイルスワクチン株に由来するdsRNAに修飾を施して低毒化を試み、最終的に140mer dsRNAにDNAキャップを施すことで樹状細胞TLR3に選択性を持ち、CTLを誘導する非炎症性アジュバントARNAXの開発に成功しました(Matsumoto et al., Nat Commun. 2015)(図1)。

ARNAXとがん抗原によるワクチン療法は、マウス移植がんモデルで全身性の炎症性サイトカインを誘導せず、樹状細胞のTLR3-TICAM-1-IRF3-IFN-β経路で抗がんCTLを誘導し腫瘍内へ浸潤させることにより多種類のがんを縮小させ、PD-L1抗体の効果を増強しました(Takeda et al., Cell Rep. 2017)(図2、3)。PD-L1抗体との併用投与では所属リンパ節(プライミング相)でCTL誘導が増強され、腫瘍内のCD8+ T cellの浸潤も多く抗原特異的CTLの増殖・活性化がおきています。PD-1/PD-L1経路をブロックすることで、プライミング相の樹状細胞においてARNAXによるCTL誘導が加速され、多くのCTLが腫瘍内に浸潤し、腫瘍内微小環境(エフェクター相)においてCTLの抑制状態が解除され効果的に腫瘍を攻撃できます。ARNAXは世界初の非炎症性の樹状細胞標的アジュバントであり、ヒト遺伝子に対してRNA干渉をおこさず、サイトカイン毒性がないため安全で、PD-1抗体療法で寛解し難い多くの固形がんにも適用の可能性があります。既存治療法が奏功しない難治性がんに対するunmet needsは極めて高く、CTLを誘導する新規アジュバントARNAXを含むがんワクチンやPD-1/PD-L1抗体との併用療法はその有力な治療法になりえます。
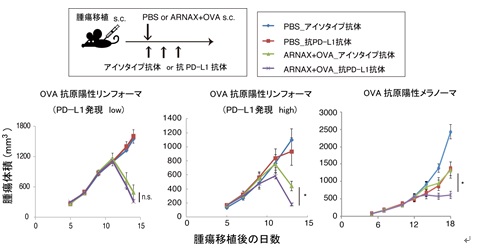
図2.ARNAX+抗原単独および抗PD-L1抗体併用による抗腫瘍効果 上図:投与プロトコル。下図: PD-L1低発現EG7腫瘍(OVA発現マウスリンフォーマ)(左図)、PD-L1高発現EG7腫瘍(中図)、OVA発現メラノーマ(右図)に対するPD-L1抗体単独、ARNAX+OVA単独あるいはARNAX+OVAとPD-L1抗体の併用による腫瘍退縮
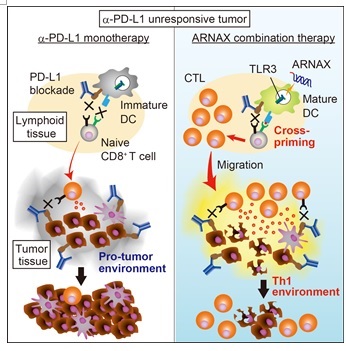
(図3)PD-1/PD-L1抗体に応答しないがんに対するARNAX療法 (Cell Reportsから引用) 左図:PD-1/PD-L1抗体に応答しないがんでは、腫瘍特異的CTLが少なくがんは増殖する。 右図:ARNAX+がん抗原投与で腫瘍特異的CTLが誘導され、腫瘍内に浸潤して腫瘍退縮を導く。抗PD-L1抗体を併用すると、所属リンパ節でCTL誘導が更に増強され、腫瘍は退縮する。
3. 開発方針
プライミングアジュバント療法は樹状細胞活性化によるCTL誘導でありプライミング相を標的とします。がん抗原が細胞死で放出され内在する場合にはアジュバント単独でCTL誘導が可能ですが、より強力なCTL誘導にはがん抗原との同時投与が必要であり、がん抗原の選択が重要です。これまでがんワクチン療法で積み上げられたがん抗原に対する知見から、がん特異抗原あるいはがん関連抗原のCD4, CD8のナチュラルペプチドや蛋白そのものとの組み合わせが有効と考えられます。PD-1/PD-L1抗体との併用など複合的免疫療法により多くのがんに対する治療効果が高まることが期待され、非臨床および臨床試験に向けて効率的なRNA合成方法の開発、有効症例を予測できるバイオマーカーの探索などが重要な課題です。当研究室では、ARNAXのGMP基準でのスケールアップ製造法と規格試験法の確立、がん抗原の選択とがん抗原高発現のマウス移植がんモデルを用いたARNAX単独とがん抗原併用での非臨床POCの取得、非臨床安全性試験などを順次進めていく予定です。